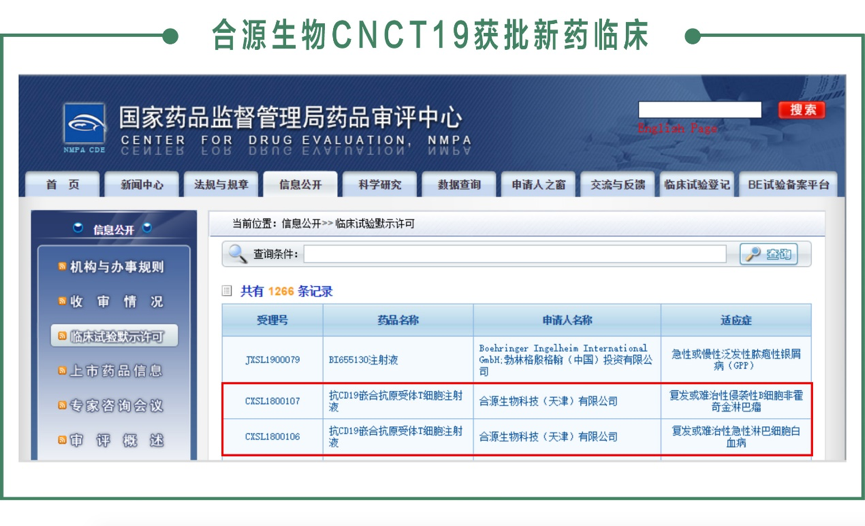
11月29日,國家藥品監(jiān)督管理局藥品審評中心正式批準合源生物科技(天津)有限公司(以下簡稱合源生物)CNCT19細胞注射液(抗CD19嵌合抗原受體T細胞注射液)的兩項新藥臨床試驗許可,分別為治療復發(fā)或難治性急性淋巴細胞白血病的臨床試驗(受理號:CXSL1800106)和治療復發(fā)或難治性侵襲性B細胞非霍奇金淋巴瘤的臨床試驗(受理號:CXSL1800107)。
合源生物CNCT19細胞注射液是具有自主知識產權的針對CD19靶點的CAR-T細胞治療產品,源自中國醫(yī)學科學院血液病醫(yī)院(中國醫(yī)學科學院血液學研究所)長期技術創(chuàng)新積累。CNCT19細胞注射液是合源生物成立一年來首個獲得新藥臨床試驗許可的免疫細胞治療產品,是公司向著為患者提供安全、高效和可及的免疫細胞治療產品的目標邁出的堅實一步和重要里程碑,體現(xiàn)了合源生物以臨床需求為導向的創(chuàng)新性研發(fā)模式和快速產業(yè)化能力。合源生物將繼續(xù)努力,將研究管線中更多的產品不斷推向臨床,造福患者。
合源生物創(chuàng)立于2018年,是一家專注于創(chuàng)新型免疫細胞治療藥物研發(fā)的生物醫(yī)藥企業(yè)。合源生物堅持以滿足臨床需求為導向,構建創(chuàng)新性研發(fā)管線,憑借高效的研發(fā)轉化平臺,通過嚴格的細胞治療產品生產和質量體系,為患者打造安全、高效、可及的免疫細胞治療產品。公司目前在北京設有1300平米研發(fā)中心、在天津設有1400平米GMP免疫細胞藥物研發(fā)轉化與生產設施,另有7000平米GMP免疫細胞藥物生產基地在建設中。

 查看更多 +
查看更多 +
 010-65960020
010-65960020


